CALORIMETRIA
La calorimetría es la ciencia de medir el calor de
las reacciones químicas o de los cambios físicos. El instrumento
utilizado en calorimetría se denomina calorímetro. La palabra calorimetría
deriva del latino "calor". El científico escocés Joseph Black fue el
primero en reconocer la distinción entre calor y temperatura, por esto se lo
considera el fundador de calorimetría.
Fue mediante calorimetría que Joule calculó el
equivalente mecánico del calor demostrando con sus experiencias que 4.18 J de
cualquier tipo de energía equivalen a
La calorimetría indirecta calcula el calor que
producen los organismos vivos mediante su producción de dióxido de carbono y de
los residuos de nitrógeno (frecuentemente amoníaco en organismos acuáticos o,
también, urea en los terrestres). Antainé de Lavoisier indicó en 1780 que la
producción de calor puede ser calculada por el consumo de oxígeno de los
animales. Naturalmente, el calor generado por los organismos vivos también
puede ser medido por calorimetría directa, en la cual el organismo entero es
colocado en el interior del calorímetro para hacer las mediciones.
CONCEPTOS:
La
calorimetría se encarga de medir el calor
en una reacción un cambio físico usando un
calorímetro. La calorimetría indirecta calcula el calor que los organismos
vivos producen a partir de la producción de dióxido de carbono y de nitrógeno
(urea en organismos terrestres), y del consumo de oxígeno.
Ejemplos
·
1. Comer con resfriado, ayunar con fiebre.
Presa
de la gripe, un hombre de 80 kg tuvo 2ºC de fiebre, es decir, tuvo una
temperatura corporal de de 39ºC en lugar de la normal de 37ºC. Suponiendo
que el cuerpo humano es en su mayor parte agua, ¿Cuánto calor se requirió para
elevar la temperatura esa cantidad?
Solución
Este
problema usa la relación entre: calor (la incógnita), la masa, calor especifico
y y cambio de temperatura.
M =
80kg
Ce =
4190 j/kg * K (para el agua)
∆T =
39ºC - 37ºC = 2ºC
Luego
el calor necesario es:
Q = m Ce ∆T
Q =
80kg (4190j/kg * K) (2K)
Q = 6.7
x 105 joule
·
2. Cambio de longitud por cambio de temperatura.
Un
elevador usa una cinta metálica de acero que tiene exactamente 50000 m de
longitud a 20ºC ¿Qué longitud tiene en un día de verano caluroso en que la
temperatura es de 35ºC?
Solución
Se
trata de un problema de expansión lineal donde: la incógnita es la nueva
longitud L = ∆L + Lo y conocemos Lo= 50000m, To=
20ºC, Tf= 35ºC y el coeficiente de expansión lineal para el acero
α=1.2 x 10-5 K-1, luego
∆L = α
∆T Lo
∆L =
1.2 x 10-5 K-1 (35ºC- 20ºC)(50000m)
∆L = 9m
Luego
L=∆L +
Lo
L= 9m
+50000m
L =
50009m.
Ejercicios
UNIDADES
DE LA CANTIDAD DE COLOR
DEFINICON:
Una posible definición de calor en
termodinámica es la siguiente:
“El calor es la transferencia de
energía a través de la frontera de un sistema debida a una diferencia de
temperaturas”
De esta definición, cabe destacar
varios aspectos que se detallan en las secciones siguientes y en otros
artículos:
·
El
calor, como el trabajo, es una transferencia de
energía, un paso de energía de un sitio a otro, no algo que se tiene o se
almacena. La frase “hace mucho calor” no es correcta en termodinámica.
·
El
calor, como el trabajo, habla de lo que pasa en la frontera del sistema, no en
su interior. Se debe a la interacción del sistema con su entorno.
·
El
calor, a diferencia del trabajo, está asociado a la diferencia de temperatura,
que es una medida de la agitación de los átomos y moléculas. Por tanto, se debe
a la transferencia de energía a través de fenómenos microscópicos (el trabajo
se refiere a los macroscópicos).
CONCEPTO
A diferencia del trabajo, el calor
carece de analogía en mecánica, sino que es un concepto nuevo.
La experiencia nos dice que si
colocamos un sistema en un cierto ambiente, el sistema evoluciona. Si colocamos
un bloque de hielo al sol, sabemos que se funde. Si ponemos un termómetro de
mercurio en la axila de una persona febril, el mercurio se dilata, y si es uno
digital, se produce una corriente eléctrica en su interior.
Todos estos cambios se producen sin que
haya trabajo asociado, simplemente por contacto. Deducimos entonces que “algo”
ha pasado del entorno al sistema y a ese algo lo denominamos “calor”.
Los efectos del calor son varios:
·
Cambio
en la temperatura del sistema
·
Cambio
de fase del sistema
·
Realización
de trabajo
La
realización de trabajo como consecuencia de la transferencia de calor se
explica al estudiar el primer
principio de la termodinámica y el funcionamiento de las máquinas térmicas. En este artículo describiremos los
dos primeros efectos.
EJERCICIO
Familiarízate con los términos utilizados para
calcular el calor específico. Es importante familiarizarse con los términos
empleados para calcular el calor específico antes de aprender la fórmula.
Tendrás que ser capaz de reconocer el símbolo de cada término y de entender lo
que significa. Aquí tienes los términos que suelen emplearse en la ecuación
para hallar el calor específico de una sustancia:
·
Delta, o el símbolo "Δ", representa el cambio de una variable.
·
Por ejemplo, si la primera temperatura (T1) es de 150 ºC y la segunda
temperatura (T2) es de 20 ºC, entonces ΔT, o el cambio de temperatura,
representa 150 ºC - 20 ºC, o 130 ºC.
·
La masa de la muestra se representa con la letra "m".
·
La cantidad de calor se representa con la letra "Q". La unidad
de medida que se emplea en el Sistema Internacional para expresar la cantidad
de calor es el julio ("J").
·
"T" es la temperatura de la sustancia.
·
El calor específico se representa con la letra "C".p"
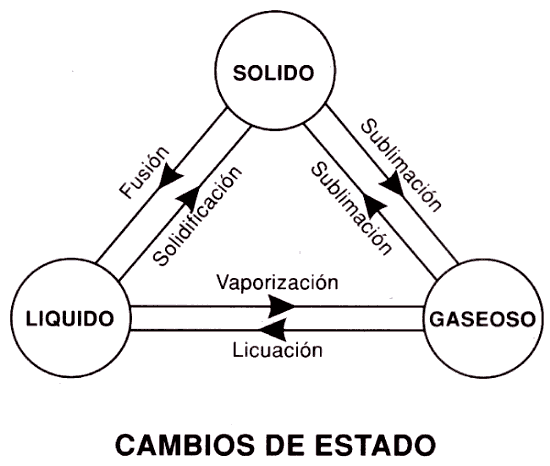
PRINCIPIOS
DE LA FUSION
Conceptos
La
fusión nuclear es una reacción en la que se unen dos núcleos ligeros para
formar uno más pesado. Este proceso desprende energía porque el peso del núcleo
pesado es menor que la suma de los pesos de los núcleos más ligeros. Este
defecto de masa se transforma en energía, se relaciona mediante la
fórmula E=mc2 , aunque el defecto de masa es muy pequeño
y la ganancia por átomo es muy pequeña, se ha de tener en cuenta que es una
energía muy concentrada, en un gramo de materia hay millones de átomos, con lo
que poca cantidad de combustible da mucha energía.
No
todas las reacciones de fusión producen la misma energía, depende siempre de
los núcleos que se unen y de los productos de la reacción. La reacción más
fácil de conseguir el la del deuterio (un protón más un neutrón) y tritio (un
protón y dos neutrones) para formar helio (dos neutrones y dos protones) y un
neutrón, liberando una energía de 17,6 MeV.
Es
una fuente de energía prácticamente inagotable, ya que el deuterio se encuentra
en el agua de mar y el tritio es fácil de producir a partir del neutrón que
escapa de la reacción.
EJEMPLO
La
fusión es un proceso físico que consiste en el cambio de estado de la materia
del estado sólido al estado líquido por la acción del calor. Cuando se calienta
un sólido, se transfiere energía a los átomos que vibran con más rapidez a
medida que gana energía. En el ciclo del agua se lleva a acabo este fenómeno
físico.
Ejemplos:
El
hielo a temperatura ambiente se convierte en agua.
Si ponemos al fuego unas velas, cambiara a parafina líquida.
Un metal a altas temperaturas llegara a hacerse líquido.
El vidrio también a altas temperaturas se vuelve líquido.
El platico se derrite con el calor o más bien el fuego.
Principios
de solidificación
La solidificación es un proceso que se logra de modo inverso a la fusión, y que se produce por el
enfriamiento de los líquidos. El punto de fusión que es aquella temperatura por la cual el sólido pasa al estado líquido, es el mismo punto en que se produce el proceso inverso de
solidificación. En el agua ocurre a 0º C.
Se
trata de un proceso físico que generalmente implica una disminución del volumen
del cuerpo, salvo en el agua, que aumenta su volumen al solidificarse.
Al sustraerse calor al líquido éste irá disminuyendo su temperatura, las
partículas que lo componen tendrán cada vez menos movimiento, hasta que se ordenan, tomando una posición en la estructura cristalina. Ese es el momento en que se opera la solidificación, y
el líquido perderá su capacidad de fluir.
EJEMPLO
2 imagen y la de abajo la 1
Ejercicios
EJERCICIOS
–
1.
Con
el diagrama de equilibrio Cu - Ni. Determinar para una aleación con el 40 % de
Ni:a)
Curva
de enfriamiento, intervalo de solidificación, fases presentes en cada
una de lasregiones que atraviesa.b)
Relación
de fases y pesos de las mismas a 1250° C para una aleación de 600 kg.
Solución:
a)
Por
encima de 1280°C toda la aleación está en estado líquido (1 fase).Entre 1280° y
1200°C (intervalo de solidificación) coexisten las fases líquida y solución sólida
(2 fases).Por
debajo de 1200°C toda la aleación ha solidificado en forma de solución sólida
(1
fase).La curva de enfriamiento aparece representada junto al diagrama
b)
Aplicando
la regla de la palanca
Vaporización
Ejemplo, si se deja un recipiente con agua a
temperatura ambiente, el agua irá
desapareciendo en forma paulatina. A determinada temperatura las moléculas, de
acuerdo a su energía, ejercen presión, conocida como “tensión
de vapor del líquido”, que aumenta cuanto mayor sea la temperatura.
Ocurre porque las moléculas dispuestas en la parte
más baja del líquido empujan a las de más arriba, que al no tener líquido por
sobre ellas, pueden “escapar” del líquido para transformarse en moléculas de
gas. Ocurre este fenómeno, por lo tanto, en la
parte superficial de los líquidos.
Se diferencia de la ebullición, pues en ésta la liberación se produce generalmente
afectando toda la masa del líquido, pues éste ha adquirido una temperatura que
no permite que continúe en forma líquida, pues ya todas sus moléculas están
cargadas con la suficiente energía como para salir del líquido; mientras en la
evaporación se produce en las moléculas de mayor energía, que son las
superficiales y en forma lenta.
La evaporación del agua permite la formación de las
nubes, que como consecuencia tren las lluvias, tan necesarias
para la vida del planeta.
Por extensión se aplica
a algo que desaparece intempestivamente sin que alguien pudiera darse cuenta de
ello. Ejemplo: “se me evaporó el dinero de mi sueldo, no sé en qué lo gasté” o
“El testigo desapareció como si se hubiese evaporado”.
Ejemplos
La evaporación ocurre como consecuencia de un
aumento natural o artificial de la temperatura.
En el caso del agua, la agitación de sus moléculas por acción de calor provoca que estas logren
ganar la energía suficiente para desprenderse del líquido y convertirse en vapor.
Los procesos de evaporación son constantes en
nuestro entorno y ocurren espontáneamente. Por ejemplo, si dejamos un
vaso de agua destapado, a la vuelta unos días descubrimos que una parte del
líquido se ha ido evaporando.
Ejercicio
EBULLICION
Se produce el fenómeno físico conocido como ebullición
cuando la temperatura de un líquido se eleva lo
suficiente como para provocar que el conjunto de moléculas del líquido se
cargue de energía (punto de ebullición). En esas circunstancias el líquido
eleva su tensión de vapor hasta alcanzar la presión que impera en el exterior
de la masa líquida. En ese momento tumultuosamente se liberan las moléculas
produciéndose la ebullición.
El punto de ebullición entonces, se logra cuando la
temperatura alcanza el valor necesario para que la presión de vapor del fluido
se iguale a la presión del medio exterior. Cada sustancia tiene un punto de ebullición
diferenciado.
Cuando el líquido
cargado de energía logra salir del líquido y convertirse en vapor, se producen
en su interior burbujas que se desprenden del resto del líquido en forma
violenta.
Se diferencia de la evaporación que solo afecta la superficie del fluido, pues en este caso el
fenómeno se produce en todo el líquido.
El punto de ebullición
del agua es de cien grados centígrados. Sin embargo en los territorios altos
donde la presión atmosférica es menor, el agua puede hervir a menos de cien
grados centígrados. En las ollas a presión el agua hierve a ciento veinte
grados centígrados, pues sus gases internos logran alcanzar mayor presión.
Por extensión y haciendo una analogía con la violencia con la cual escapan las burbujas
del líquido, se aplica a las situaciones tumultuosas o de gran revuelo social.
Por ejemplo “el anuncio del gobierno provocó una gran ebullición, con
desbordes populares”.
EJEMPLOS
El agua, por ejemplo, tiene su punto de ebullición en los 100ºC, siempre que se encuentre sometida a una presión semejante a la del nivel del mar. En mayor altura, la presión de la atmósfera se reduce y el agua requiere de menor temperatura para llegar a la ebullición. Cuando el agua comienza a hervir, la temperatura deja de incrementarse y se genera una rápida evaporación.
EJERCICIOS
Considerando la siguiente tabla de
puntos de ebullición:
|
HALOGENUROS
DE HIDREOGENO
|
Masa
molecular
|
Te en
ºC
|
Gases
inertes
|
Masa
atómica
|
Te en
ºC
|
|
HF
|
20
|
19,5
|
Ne
|
20
|
− 246
|
|
HCl
|
36,5
|
115
|
Ar
|
39,9
|
− 186
|
|
HBr
|
80,9
|
− 67
|
Kr
|
83,8
|
− 152
|
|
HI
|
128
|
− 35
|
Xe
|
131
|
− 108
|
y los conocimientos de las teorías de
enlace:
a) Explica la tendencia general que se observa
en los puntos de ebullición de los halogenuros de hidrógeno, y la excepción
correspondiente al valor que se observa para el fluoruro de hidrógeno.
b) Explica por qué los halogenuros de
hidrógeno tienen puntos de ebullición significativamente superiores a los gases
inertes siendo sus masas moleculares o atómicas, respectivamente, similares
entre sí.
Solución:
a) Al bajar en
el grupo de los halógenos disminuye el valor de su electronegatividad, por lo
que el enlace H − halógeno se va haciendo cada vez menos polar, disminuyendo
las fuerzas atractivas entre las moléculas polares, y aumentando las fuerzas
intermoleculares de Van der Vaals, que al crecer con el volumen molar o masa
molecular, es la responsable del descenso del punto de fusión de los
halogenuros de hidrógeno conforme se baja en el grupo. La excepción del valor
tan elevado del punto de fusión del HF, se debe a que sus moléculas se unen por
enlaces de hidrógeno, mucho más fuerte que las fuerzas dipolares y de Van der
Vaals. Este enlace se produce al unirse el átomo de hidrógeno, por enlace
covalente, a un átomo muy electronegativo y de pequeño radio atómico como es el
flúor, lo que provoca la aparición de un dipolo en el enlace; y por ello,
cuando el polo positivo de una molécula de HF se aproxima al polo negativo de
otra, aparece una atracción electrostática entre ellas que es lo que constituye
el enlace de hidrógeno.
b) En los gases
nobles, átomos no polarizados, las únicas fuerzas atractivas de Van der Vaals
que aparecen entre los átomos son las de dispersión, las más débiles, pues se
deben a la interacción entre un dipolo instantáneo e inducido que produce. La
diferencia de intensidad de estas fuerzas respecto de las que aparecen en los
halogenuros de hidrógeno, dipolo-dipolo, son las responsables de los bajos
puntos de fusión de los gases nobles respecto de los de los halogenuros de
hidrógeno.
PROPORCION
DEL CALOR
Propagación del calor. El calor es una de las múltiples formas en que se manifiesta la energía, y la transferencia de calor es el proceso mediante el cual se intercambia energía en forma de calor entre distintos cuerpos o entre diferentes partes de un cuerpo que estén a temperaturas desiguales. La transferencia de calor ocurre mediante convección, radiación y conducción. Estas tres formas pueden producirse a la vez, aunque por lo regular predomina una de ellas.
EJEMPLOS
- Utensilios metálicos para cocinar, como por ejemplo una olla de
acero. Esta recibe el calor en la base y luego se propaga por toda la
olla. Es por ello que las asas tienen que ser de un material aislante como
madera o plástico, para no sufrir quemaduras.
- Tenemos un vaso de leche que está muy caliente. En su interior se
introduce una cuchara. Al pasar un rato, si se toca la cuchara que se
encuentra en su interior, se nota que se va calentando cada vez más. Esta
transferencia de calor se ha producido desde una sustancia, que es la
leche, hasta un cuerpo, que es la cuchara.
EJERCICIOS
EQUVALENCIA
MECANICA DEL CALOR
A
comienzos del siglo XIX la gente estaba interesada en mejorar la eficiencia de
las máquinas de vapor y de los cañones. Un hecho evidente era que después de
algunos disparos los cañones se recalentaban hasta tal punto que se volvían
inservibles. Esto llevó a la observación que debía existir una conexión entre
las fuerzas mecánicas y químicas involucradas en el disparo y el
"calórico" como se llamaba el calor en esa época.
Fue
Joule quien estableció la relación precisa entre energía mecánica y calor.
Ejemplos
Joule
utilizando una rueda con paletas conectada a un conjunto de poleas con pesos en
sus extremos pudo mostrar una relación precisa entre la energía mecánica de los
pesos en las poleas y el aumento de temperatura del agua en el recipiente,
debido a la rotación de las paletas. Esto da:
1 cal= 4.186 J
PRIMERA
LEY DE TERMODINAMICO
Se identifica con el nombre de termodinámica a la rama de la física que hace foco en el estudio de los vínculos existentes entre el calor y las demás variedades de energía. Analiza, por lo tanto, los efectos que poseen a nivel macroscópico las modificaciones de temperatura, presión, densidad, masa y volumen en cada sistema.
Es importante subrayar que existe una serie de conceptos básicos que es fundamental conocer previamente a entender cómo es el proceso de la termodinámica. En este sentido uno de ellos es el que se da en llamar estado de equilibrio que puede definirse como aquel proceso dinámico que tiene lugar en un sistema cuando tanto lo que es el volumen como la temperatura y la presión no cambian.
Ejemplos
La primera
ley de la termodinámica establece que la energía no se crea,
ni se destruye, sino que se conserva. Entonces esta ley expresa que,
cuando un sistema es sometido a un ciclo
termodinámico, el calor cedido por el sistema será igual al trabajo
recibido por el mismo, y viceversa.
Es decir Q = W,
en que Q es el calor suministrado por el sistema al medio ambiente y W el
trabajo realizado por el medio ambiente al sistema durante el ciclo.
Un ejemplo sencillo seria: Al remover con un taladro el
agua contenida en un recipiente, le estamos aplicando trabajo, que es igual al
calor que este emite al medio ambiente al calentarse. En este caso, el sistema
puede ser el agua, el medio sería el taladro, el aire circundante y todo lo que
está fuera del sistema que no sea agua (pues lo que está afuera recibirá calor
del sistema).
Ejercicios
Se sitúan 15 L de gas ideal en un recipiente a 27
ºC. El recipiente cuenta con un pistón móvil libre de rozamiento. La presión en
el exterior se mantiene constante a 750 mmHg. Determina, si se eleva la
temperatura a 190 ºC:
1.
El trabajo realizado en el proceso
2.
La variación de energía interna que tiene lugar
3.
El calor transferido durante el mismo
4.
Representa el proceso en un diagrama presión - volumen ( p - V )
Datos: cv = 5·R/2 ; R = 8.31 J/ mol·K
Solución
·
Volumen inicial Vi = 15 L = 15·10-3 m3
·
Temperatura inicial Ti = 27 ºC = 300.15 K
·
Temperatura final Tf = 190 ºC = 463.15 K
·
Presión constante p = 750 mmHg = 750·101325/760 = 99991.77 Pa
·
Calor específico a volumen
constante cv = 5·R/2
·
Constante universal de los gases ideales R = 8.31 J/ mol·K
SEGUNDA
LEY DE TERMODINAMICAS
La
incapacidad de la primera ley de identificar si un proceso puede llevarse a
cabo es remediado al introducir otro principio general, la segunda ley
de la termodinámica. La primera ley no restringe la dirección de un
proceso, pero satisfacerla no asegura que el proceso ocurrirá realmente. Cuando
los procesos no se pueden dar, esto se puede detectar con la ayuda de una
propiedad llamada entropía. Un proceso no sucede a menos que satisfaga la
primera y la segunda ley de la Termodinámica.
El empleo de la segunda ley de la termodinámica no se limita a identificar la
dirección de los procesos. La segunda ley también afirma que la energía tiene
calidad, así como cantidad. La primera ley tiene que ver con la cantidad y la
transformación de la energía de una forma a otra sin importar su calidad.
Preservar la calidad de la energía es un interés principal de los ingenieros, y
la segunda ley brinda los medios necesarios para determinar la calidad, así
como el nivel de degradación de la energía durante un proceso. La naturaleza
establece que el total de energía asociada con una fuente térmica nunca puede
ser transformada íntegra y completamente en trabajo útil. De aquí que todo el
trabajo se puede convertir en calor pero no todo el calor puede convertirse en
trabajo.
EJEMPLOS
EJERCICIOS
La segunda
ley de la Termodinámica establece cuales procesos de la naturaleza
pueden ocurrir o no. De todos los procesos permitidos por la primera ley, solo
ciertos tipos de conversión de energía pueden ocurrir.
Existen
procesos que son compatibles con la ley de la termodinámica pero que
se cumplen en un orden gobernado por la segunda ley, estos procesos son:
·
Cuando dos objetos que están a diferente temperatura se ponen en
contacto térmico entre sí, el calor fluye del objeto más cálido al más frío,
pero nunca del más frío al más cálido.
·
La sal se disuelve espontáneamente en el agua, pero la extracción de
la sal del agua requiere alguna influencia externa.
·
Cuando se deja caer una pelota de goma al piso, rebota hasta
detenerse, pero el proceso inverso nunca ocurre.
La
segunda ley afirma que no es posible construir una maquina capaz de construir
por completo, de manera continua, la energía térmica en otras
formas de energía.
La aplicación de
esta ley desde el punto de vista de Ingeniería es
en relación con la eficiencia limitada de las maquinas térmicas.
La
forma más simple de enunciar la segunda ley de la termodinámica es
que “el calor jamás
fluye espontáneamente de un objeto frío a un objeto
caliente“. Existen dos formas de enunciar la segunda ley, esas son:
·
Kevin-Planck donde enuncia que “es
imposible construir una máquina térmica que, operando en un ciclo,
no tenga otro efecto que absorber la energía térmica de una fuente y
realizar la misma cantidad de trabajo“
·
Clausius donde enuncia que “es
imposible construir una máquina cíclica, que no tenga otro efecto que
transferir calor continuamente de un cuerpo hacia otro, que se encuentre
a una temperatura más elevada“
VIDEOS DE LOS TEMAS: